в корзину
Корзина покупокРАСПУТАНА ТАЙНА БЕЛКОВ, СВЯЗАННЫХ С ДИАБЕТОМ
РАСПУТАНА ТАЙНА БЕЛКОВ, СВЯЗАННЫХ С ДИАБЕТОМ
Большое количество заболеваний, включая диабет, болезни Альцгеймера и Паркинсона связаны с тем, что некоторые полипептиды могут неправильно сворачиваться, агрегируя при этом в фибриллы, которые затем слипаются с образованием белковых бляшек. Новая работа позволила исследователям определить строение интермедиата, который приводит к образованию белковых фибрилл, связанных с возникновением диабета II типа.
Соединения, нарушающие образование такого типа интермедиатов могут в перспективе стать основой для новых способов профилактики этого заболевания, которое в последнее время представляет собой серьезную проблему для здравоохранения. Диабет II типа описывается как невозможность вырабатывать достаточное для нормального обмена веществ количеств инсулина или же неправильную реакцию организма на инсулин, в результате чего увеличивается концентрация глюкозы в крови, что, в свою очередь, приводит к серьезным проблемам для здоровья.
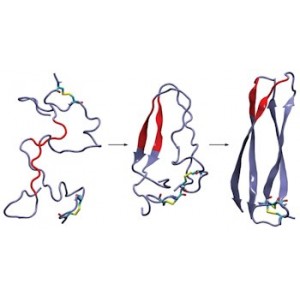
Полипептид, изученный в группе Мартина Занни (Martin T. Zanni) из Университета Висконсина – человеческий островной амилоидный пептид [human islet amyloid polypeptide (IAPP)] или амилин. Амилин представляет собой гормон, генерируемый поджелудочной железой параллельно с инсулином, обычно этот белок подавляет аппетит человека. Образование амилиновых бляшек обычно связывают с развитием диабета II типа. Два десятилетия назад исследователи идентифицировали короткий сегмент посередине цепочки амилина, этот сегмент играет важную роль в образовании β-складчатой вторичной структуры, характерной для фибрилл.
Тем не менее, когда в 2007 году Роберт Тико (Robert Tycko) расшифровал структуру амилина с помощью твердотельного ЯМР, он обнаружил, что этот критический для образования β-складчатой структуры является частью домена с неупорядоченной вторичной структурой, как отмечает Занни – это казалось бессмысленным. Исследователи представляли, что мутация этого сегмента может предотвратить образование фибриллы, однако , казалось, что этот неупорядоченный домен должен мутировать, не влияя при этом на общую структуру фибриллы.
Исследователям из группы Занни удалось решить эту загадку – с помощью двумерной инфракрасной спектроскопии и компьютерного моделирования они изучили β-складчатую структуру фибриллы амилина и обнаружили, что загадочный сегмент амилина образует β-складки при агрегации интермедиата, который образуется при переходе амилина в фибриллы.
Вторичная β-складчатая структура интермедиата отличается от таковой, характерной для фибрилл – по словам Тико, эти результаты исследования оказались для него и других специалистов по строению и свойствам амилина, мягкого говоря, неожиданными. Тико добавляет, что исследование Занни продемонстрировало возможности двумерной ИК-спектроскопии в изучении систем, способных к формированию амилоидных бляшек – такой метод исследования позволяет использовать меньшее количество образца, а также получать результаты в более быстрой временной шкале по сравнению с твердотельным ЯМР.
Тем не менее, пока еще остается неясным, сколько молекул амилина организуются в β-складчатый интермедиат, пока еще неизвестно. Занни оценивает, что минимальное количество молекул белка, которые агрегируют, равно пяти, однако не может уточнить, чему равно максимальное количество белков в интемедиате, в то время, как бляшки из амилина содержат уже тысячи пептидных нитей.
Определение структуры интермедиата позволяет определить различную восприимчивость разных биологических видов к диабету. Так, например, хомяки, кролики и крысы не болеют диабетом II типа. Все эти организмы вырабатывают амилин, однако в сегменте белка, ответственным за формирование опасного интермедиата у этих животных присутствует остаток аминокислоты пролина. Известно, что остаток пролина ингибирует образование βскладчатых структур, тем самым препятствуя образованию фибрилл и амилиновых бляшек.
Источник: Proc. Natl. Acad. Sci. USA 2013, DOI: 10.1073/pnas.1314481110
О КОМПАНИИ
 ЗАО "Союзхимпром" более 15 лет работает в области комплексного оснащения химических и эколого-аналитических лабораторий, предприятий разного профиля, государственных служб охраны окружающей среды и санитарного контроля Урала, Сибири и Дальнего Востока.Все что Вам нужно. Основное преимущество новосибирского ЗАО "Союзхимпром" — комплексность поставки.
ЗАО "Союзхимпром" более 15 лет работает в области комплексного оснащения химических и эколого-аналитических лабораторий, предприятий разного профиля, государственных служб охраны окружающей среды и санитарного контроля Урала, Сибири и Дальнего Востока.Все что Вам нужно. Основное преимущество новосибирского ЗАО "Союзхимпром" — комплексность поставки.
КОНТАКТЫ
- 8-383-289-98-09; 289-98-08; 279-98-76; 279-97-52
- info.shp@yandex.ru
- shp-nsk
- 630015, Россия, Новосибирск, ул. Королева 40, корпус 87
Союзхимпром - лабораторное оборудование © 2024