в корзину
Корзина покупокДА, ЭТИЛЕНДИОН ВСЕ ЖЕ СУЩЕСТВУЕТ!
ДА, ЭТИЛЕНДИОН ВСЕ ЖЕ СУЩЕСТВУЕТ!
Существует этилендион или нет? Дискуссии об этой молекуле, которую можно считать димером моноксида углерода, продолжаются уже десятилетия.
Исследователям из США удалось поставить убедительную точку в споре, представив надежные доказательства существования этого таинственного соединения. С помощью фотоэлектронной спектроскопии фотоотрыва (photodetachment photoelectron spectroscopy) химики смогли получить этилендион и провести спектральное изучение электронных состояний в молекуле.
Несмотря на внешне простое химическое строение – O=C=C=O (молекула этилендиона должна отличаться системой трех кумулированных двойных связей), загадочное вещество оказалось крепким орешком. Впервые об этом соединении упомянули в 1913 году, как об интермедиате приводящей к образованию моноксида углерода (СО) реакции оксалилбромида с ртутью. В 1940-х годах утверждалось, что этилендион является активным компонентом средства «Глиоксилид», рекламировавшегося как медицинский препарат, способный решить огромное количество проблем от лечения усталости до борьбы с раком, что (как состав препарата, так и его свойства) вскоре было признано, как фальсификация. Попытки синтеза OCCO предпринимались десятилетиями, однако все эти попытки заканчивались ничем.
Рисунок из Angew. Chem. Int. Ed.. doi: 10.1002/anie.201503423
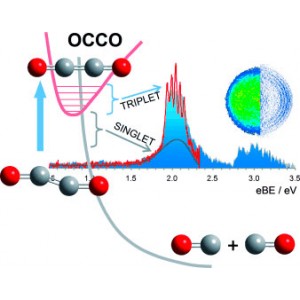
Андрей Санов (Andrei Sanov), Эндрю Диксон (Andrew Dixon) и Тиан Сю (Tian Xue) из Университета Аризоны смогли доказать существование OCCO. Им удалось конвертировать глиоксаль (C2H2O2) в однозарядный этилендион-анион. Затем с помощью фотоэлектронной спектроскопии фотоотрыва исследователи изучили незаряженную частицу, образующуюся в результате потери анионом своего отрицательного заряда. Методика основана на том, что в результате подачи определенного количества энергии (в форме фотона) на анион, «лишний» электрон можно оторвать от отрицательно заряженной частицы. Отношение энергии высвобождаемого электрона к энергии входящего фотона позволяет получить энергетический спектр, по которому, в свою очередь, можно делать выводы об энергетических состояниях и характере колебаний нейтральной частицы, образующейся в результате такого спектрального исследования.
Фотоэлектронные спектры этилендиона позволили зафиксировать оба возможных состояния ОССО – триплетное и преддиссоциативное синглетное, свойства которых согласуются с результатами квантово-химических расчетов.
Самое низкое по энергии состояние OCCO представляет собой линейное триплетное состояние, характерное наличием двух неспаренных электронов, обеспечивающих этилендиону бирадикальную природу, сходную с бирадикальной природой молекулярного кислорода. Это триплетное состояние может легко перейти в синглетное состояние, в котором спаренные электроны находятся на несвязывающей орбитали.
Такое электронное строение заставляет молекулу быстро диссоциировать на две молекулы CO, что, в конечном итоге, и обуславливает неуловимость OCCO. Переход из триплетного в синглетное состояние происходит за доли наносекунды, однако, в отличие от нашей шкалы движения времени, это достаточно продолжительный отрезок между событиями в мире молекул, позволяющий зафиксировать триплетную форму этилендиона и доказать возможность существования молекулы О=С=С=О.
Источник: Angew. Chem. Int. Ed. doi: 10.1002/anie.201503423
О КОМПАНИИ
 ЗАО "Союзхимпром" более 15 лет работает в области комплексного оснащения химических и эколого-аналитических лабораторий, предприятий разного профиля, государственных служб охраны окружающей среды и санитарного контроля Урала, Сибири и Дальнего Востока.Все что Вам нужно. Основное преимущество новосибирского ЗАО "Союзхимпром" — комплексность поставки.
ЗАО "Союзхимпром" более 15 лет работает в области комплексного оснащения химических и эколого-аналитических лабораторий, предприятий разного профиля, государственных служб охраны окружающей среды и санитарного контроля Урала, Сибири и Дальнего Востока.Все что Вам нужно. Основное преимущество новосибирского ЗАО "Союзхимпром" — комплексность поставки.
КОНТАКТЫ
- 8-383-289-98-09; 289-98-08; 279-98-76; 279-97-52
- info.shp@yandex.ru
- shp-nsk
- 630015, Россия, Новосибирск, ул. Королева 40, корпус 87
Союзхимпром - лабораторное оборудование © 2024